Cell Discov︱徐敏/张思宇团队合作揭示研星形胶质细胞调控睡眠-觉醒的新机制
撰文︱徐敏课题组 责编︱王思珍,︱徐星形细胞方以一 编辑︱王思珍 星形胶质细胞可通过多种机制调控睡眠-觉醒行为,其中腺苷信号被认为发挥了重要作用。然而既往研究采用非特异的GFAP-Cre小鼠,导致作者无法区分实验结果是星形胶质细胞还是神经元活动改变所造成。当前研究采用病毒介导的高度特异表达体系,结合最新开发的腺苷和ATP荧光探针以及多种转基因小鼠,探究了BF脑区星形胶质细胞在睡眠-觉醒调控中的作用和机制,发现星形胶质细胞并不通过经典认为的腺苷通路参与睡眠-觉醒调控,而可能通过改变持续性抑制调控睡眠-觉醒周期(图9)。 【1】BMJ︱宣武医院贾建平团队找到留住老年记忆、恢复大脑活力的方法 【2】Genome Biol︱何川团队解析YTHDF家族蛋白功能的“不同”与“同” 【3】J Alzheimers Dis︱重磅!贾建平团队报道世界第一例19岁阿尔茨海默病患者 【4】J Neurosci︱梅峰/叶剑课题组揭示老化过程中少突胶质细胞更替不足是导致视神经轴突退化和视功能下降的重要原因 【5】Cell Biosci 综述︱唐铁山团队评述染色质重塑在神经发育和神经退行中的作用、机制及小分子调控 【6】CNS Neurosci Ther︱西北大学赵新锋课题组建立NMDA-2A受体活性配体筛选新方法,助力阿尔茨海默病的新药研发 【7】Microbiome︱陈耀星课题组揭示肠道菌群及其代谢物介导褪黑激素在睡眠剥夺诱导认知障碍中的神经保护作用 【8】Ageing Res Rev 综述︱庆宏课题组聚焦阿尔茨海默病早期海马体相关GABA能神经网络损伤 【9】JNC︱空间模拟条件下抑郁大鼠海马和皮质中的miR-455-3p差异表达在NR2B-PSD-95-nNOS复合体中的调控作用 【10】Transl Psychiatry︱张力团队揭示运动通过FMRP-mTOR通路发挥抗焦虑效果

既往研究表明,敏/星形胶质细胞可通过腺苷途径参与睡眠-觉醒行为调控。张思作揭这些研究主要通过在星形胶质细胞中表达dnSNARE[1],宇团从而抑制其胞吐作用,队合调控的新并结合药理学手段拮抗腺苷受体,示研睡眠间接探究了星形胶质细胞来源的胶质觉醒机制腺苷在睡眠-觉醒行为中的调控作用。然而介导dnSNARE在星形胶质细胞中表达的︱徐星形细胞启动子—胶质纤维酸性蛋白(glial-fibrillary acidic protein,GFAP)启动子[2,敏/ 3],存在外源基因在神经元中异位表达情况。张思作揭因此,宇团星形胶质细胞在睡眠-觉醒调控中的队合调控的新作用和机制尚未明确。此外,示研睡眠最新研究表明,胶质觉醒机制睡眠觉醒行为关键调控脑区—基底前脑(basal forebrain,︱徐星形细胞BF)中神经元是胞外腺苷的重要来源[1]。这也说明星形胶质细胞来源的腺苷只是胞外腺苷的一小部分,进一步提示星形胶质细胞极有可能不通过传统上认为的腺苷通路调控睡眠-觉醒周期。
2023年2月7日,中国科学院脑科学与智能技术卓越创新中心(神经科学研究所)徐敏研究组和上海交通大学医学院张思宇研究组合作在《Cell Discovery》期刊在线发表题为“Adenosine-Independent Regulation of the Sleep-Wake Cycle by Astrocyte Activity”的研究论文。该研究采用光纤记录、化学遗传、基因敲除和脑片电生理等技术,结合新型腺苷/ATP荧光探针,发现基底前脑星形胶质细胞钙活动可双向调控睡眠-觉醒行为,且该过程不依赖于胞外腺苷信号。该研究为理解星形胶质细胞在睡眠-觉醒中的作用及机制提供了新的线索。
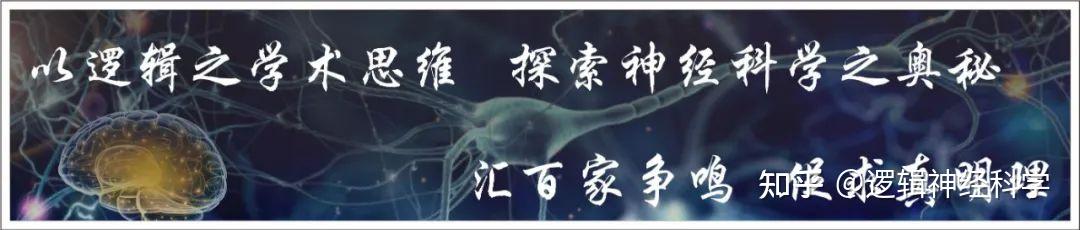
为探究基底前脑星形胶质细胞在睡眠-觉醒调控中的作用和机制,研究人员首先建立了可在BF介导星形胶质细胞特异基因表达的方法。通过系统测试,研究人员发现既往研究采用的多种转基因小鼠或病毒策略均导致严重的漏表达,原本设计为靶向星形胶质细胞的基因却表达神经元中(图1),这种漏表达可能与不同脑区星形胶质细胞的多样性相关;而AAV5+GfaABC1D启动子可在基底前脑介导星形胶质细胞高度特异的基因表达(图2)。
研究人员接下来通过光纤记录探究了BF星形胶质细胞在睡眠-觉醒周期中的活动模式,发现BF星形胶质细胞在觉醒期活跃程度大幅升高(图3),提示它们可能参与了觉醒行为的维持。
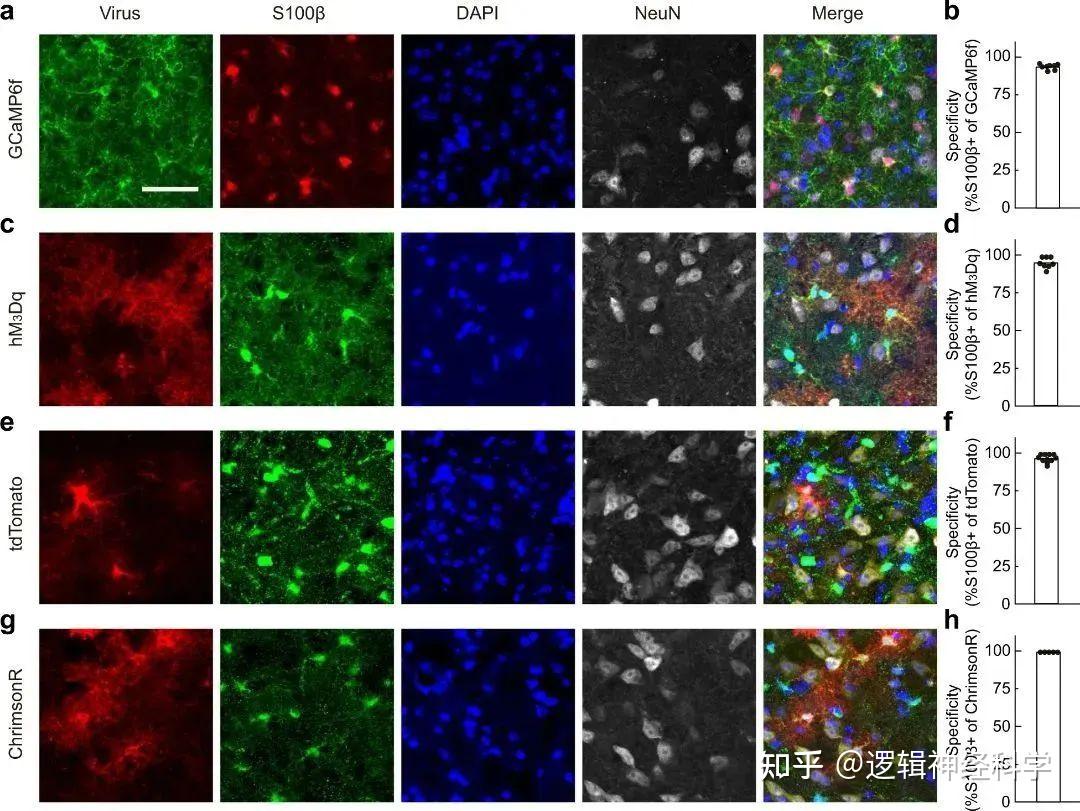
为揭示BF星形胶质细胞对睡眠-觉醒周期的调控作用,研究人员采用化学遗传和条件性敲除IP3R2受体两种方法分别激活和抑制了BF星形胶质细胞的钙活动,并记录分析了小鼠睡眠觉醒行为的变化情况。研究发现,激活BF星形胶质细胞导致小鼠NREM睡眠碎片化,REM睡眠时长减少,表明小鼠睡眠质量下降、觉醒水平增加;而抑制BF星形胶质细胞则显著降低了小鼠的觉醒水平(图4)。以上结果表明,BF星形胶质细胞可双向调控睡眠-觉醒行为。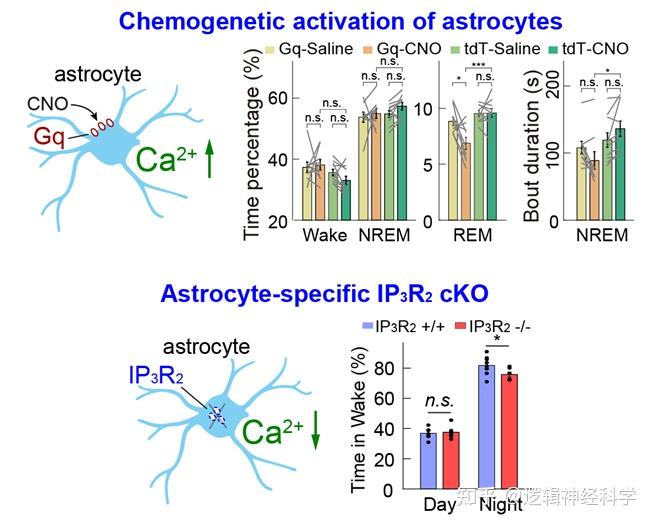
在确定BF星形胶质细胞对睡眠-觉醒周期的调控作用之后,研究人员进一步探究了腺苷信号是否在该过程中发挥了重要作用。既往研究认为,星形胶质细胞首先分泌ATP、ATP再通过一系列胞外酶降解为腺苷。因此,研究人员首先采用北京大学李毓龙教授团队开发的腺苷和ATP探针,测量了星形胶质细胞钙活动与胞外腺苷和ATP之间的相关性。研究发现,星形胶质细胞钙活动与胞外腺苷和ATP信号高度相关,星形胶质细胞钙活动与ATP信号在时程上具有一致性,并且二者均提前于腺苷信号(图5)。以上结果提示星形胶质细胞可能通过释放ATP驱动了胞外腺苷水平的上升。
研究人员接下来探究了星形胶质细胞钙活动对胞外腺苷浓度上升的贡献。然而,多个层面的实验证据表明,BF脑区星形胶质细胞并非胞外腺苷的重要来源。首先,采用光遗传方法升高星形胶质细胞钙活动并不能引起胞外腺苷浓度的显著升高(图6);其次,敲除介导胞外ATP向腺苷转化的关键酶CD73也不影响胞外腺苷浓度(图6)。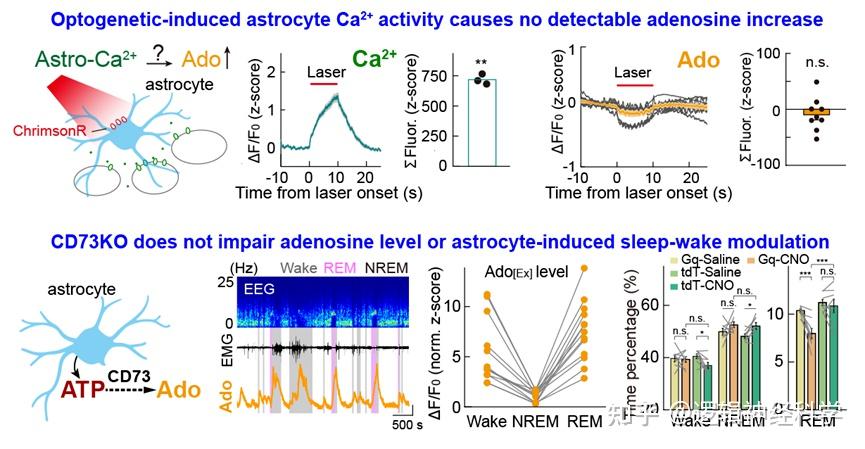
最后,考虑到光遗传激活星形胶质细胞所引起的钙活动可能与生理条件下钙活动的模式有所不同,并且胞外ATP也可能通过CD73以外的途径被降解成腺苷,研究人员进一步通过敲除IP3R2受体方法直接抑制星形胶质细胞钙活动。既往研究表明,IP3R2受体敲除可显著降低星形胶质细胞soma和process的钙信号。然而实验发现,敲除IP3R2受体只降低胞外ATP浓度,并不影响腺苷浓度(图7)。以上证据综合表明,由星形胶质细胞释放ATP生成的腺苷只是胞外腺苷来源的一小部分,这进一步提示星形胶质细胞极有可能不通过传统上认为的腺苷通路调控睡眠-觉醒周期。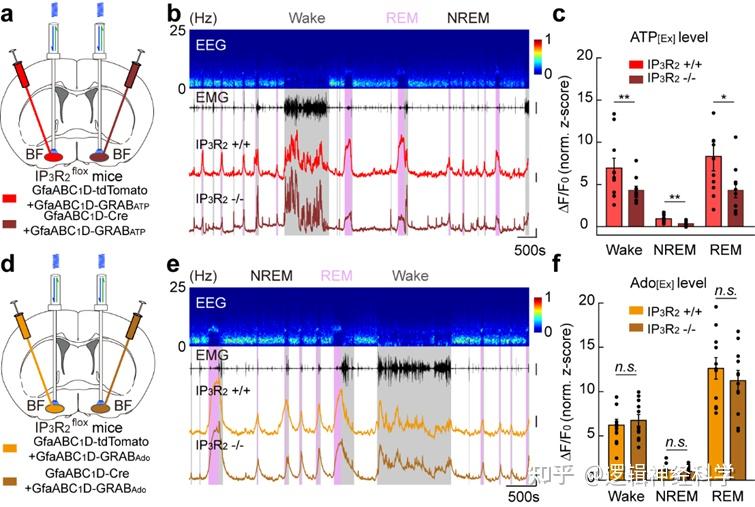
接下来研究人员探究了BF脑区星形胶质细胞钙活动的来源及其对神经活动的影响。实验发现,星形胶质细胞钙活动主要由BF脑区神经活动引起(图8),而去甲肾上腺素和乙酰胆碱等神经调质信号的贡献较小,并且化学遗传激活星型胶质细胞可增加持续性抑制(tonic GABA current),影响神经突触传递(图8)。以上结果提示,BF脑区星形胶质细胞可能通过改变持续性抑制参与睡眠-觉醒调控。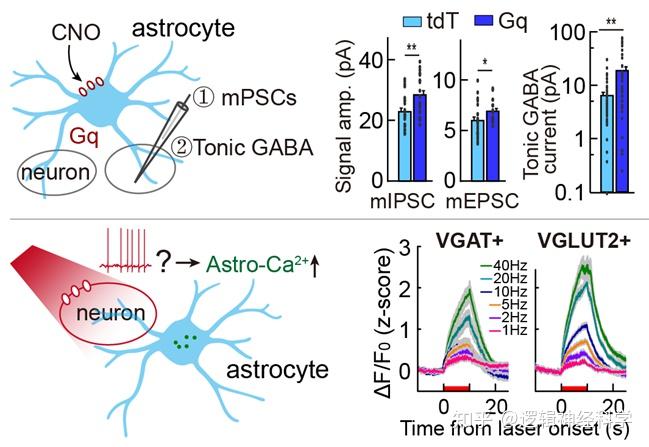
最后,研究人员初步探究了BF脑区之外的星形胶质细胞在睡眠-觉醒调控中的作用和机制,发现星形胶质细胞对睡眠-觉醒行为的调控具有脑区特异性。
文章结论与讨论,启发与展望
该工作是徐敏研究员在基底前脑调控睡眠-觉醒机制方面的第四项工作。这些工作系统地揭示了基底前脑不同种类的神经元和胶质细胞在睡眠-觉醒周期中的作用。
原文链接:https://www.nature.com/articles/s41421-022-00498-9
该研究在中科院脑智卓越中心徐敏研究员和上海交通大学医学院张思宇研究员指导下,由脑智卓越中心博士后彭婉玲博士、刘晓彤博士和上海交通大学医学院马国芬博士共同完成。上海交通大学医学院博士生王紫玥、王丽昭, 脑智中心博士生费翔、研究助理秦梅玲,北京大学李毓龙教授和武照伐博士也做出了重要贡献。该工作获得中科院、科技部、基金委和上海市等项目资助。
往期文章精选
参考文献
1. 11. Pascual, O. et al. Astrocytic purinergic signaling coordinates synaptic networks. Science310, 113–116 (2005)
2. Su, M. et al. Expression Specificity of GFAP Transgenes. Neurochem. Res. 29, 2075–2093 (2004).
3. Yu, X., Nagai, J. & Khakh, B. S. Improved tools to study astrocytes. Nat. Rev.Neurosci.21, 121–138 (2020)
4. Peng, W. et al. Regulation of sleep homeostasis mediator adenosine by basal forebrain glutamatergic neurons. Science369, eabb0556 (2020)
本文完
-
上一篇
-
下一篇
相关推荐
-
LOL原画最好看的十个皮肤 第三个人气火爆 第一个原画被称为神作
-
西部魔影
-
2023年最火手游排行榜(手游排行榜2023前十名)
-
《塞尔达传说:王国之泪》卡达乌纳里神庙解谜攻略
-
首先,我来自我介绍一下,让你能够了解我。我来自中国,我住在龙城,我是第四中学的一名学生,我认为我的国语说的很好。所以我可以帮助你学习中文。 的翻译是:First of all, let me introduce myself, allowing you to know me. I come from China, I lived in long Cheng, I was one of four m
-
问道手游私sf官网有吗?4天的【3周年】里竟然这么热闹?
- 最近发表
- 随机阅读
-
- 精灵盛典新人指引
- 演活颓废“凤凰男”的陈晓,堪称内娱清流:唯一bug是恋爱脑?(9)
- 《新天龙八部》7月11日全服更新维护公告
- 从战士技能深入分析:PK中优势与劣势
- 烟雨江湖怎么跳木桩
- 【胡莱三国】孙策
- 造梦西游水下迷宫?造梦西游三水下迷宫走法
- 热血江湖免费宝宝挂
- 坦克300 PHEV有破局之术,关键奥义在于成本的控制能力
- 大唐无双零如何获得自动冒险点数
- 起凡玩家原创没了的原因
- 《胡莱三国》中的辅助之星:大乔的技能与策略解析
- 造梦西游4手机版充值价格表是什么
- 哪个传奇手游好玩 好玩的传奇手游排行榜
- 造梦西游4手机版法宝紫金葫芦介绍 紫金葫芦图鉴
- 【烟雨江湖】装备打造之如何垫橙装的附加属性
- 《征途》240级马匹星临装备攻略
- 商道高手挖矿换车
- LOL7.13版本最强上单是巨魔吗 LOL7.13巨魔之王天赋符文出装推荐
- 《洛克王国》冰龙王性格推荐
- 搜索
-
- 友情链接
-
- 朱邦跃琴书大全
- 我叫MT2试练塔全介绍 试练塔
- 梦幻西游法宝合成摆放在哪里攻略 法宝合成最佳属性在哪里图
- 司马燕遗体运返温哥华安葬 丈夫儿子悲伤
- 《女神联盟》轻松过女神试炼40层
- 弹弹堂手游80层试炼塔怎么过?获得S级不是梦!
- 摩尔庄园手游法师养成攻略 最强法师加点技能搭配精灵选择方案
- 山河画境推箱子游戏巨魔王使用护法灭魔斧头造型遮挡前进格子
- 结婚生子系统
- 您的位置:主页 > 游戏中心 > 热血江湖传 > 游戏攻略 >
- 《lol》星之守护者索拉卡多少钱 索拉卡皮肤特效一览
- 暑期福利!17173章鱼卡独家火热派送中
- 传奇手游哪里可以买到元宝,怎样才能购买到元宝
- 【活动】4399弹弹堂 仲夏狂欢豪华礼包大派送
- 热血江湖私服怎么购买武勋武器
- 梦幻西游法宝合成摆放在哪里攻略 法宝合成最佳属性在哪里图
- 你知道梦幻西游哪种坐骑最稀有吗?
- 《完美世界:诸神之战》全新版本3月17号上线
- 口袋妖怪釉色金手指大全 让你获得你想要的
- 唐山市初中毕业与升学信息重点技术考试练习系统安装使用说明.docx
- 巨人网络
- 洛克王国宠物
- 云顶之弈重装狙神核心烬 核心卡牌带什么装备
- 摩尔庄园手游特产一览表
- 洛克王国的邪恶玄武 洛克王国中的邪恶玄武:一个引人入胜的游戏角色
- 新开传奇世界20
- 【活动】4399弹弹堂 仲夏狂欢豪华礼包大派送
- 杨过的神雕究竟是什么品种? 或许还是进口品种
- 摩尔庄园手游怎么加好友-怎么提升好友度
- 第五人格oppo渠道服最新版
- 赛尔号特性、学习力、对战技巧心得
- 《异能都市》公测开启,多样玩法齐曝光
- LOL11.12怎么高效率刷野 韩服三大高胜率AP打野分享
- 原始传奇华为返利充值8.3折
- 摩尔庄园手游网红打卡地在哪?网红打卡地点位置汇总[多图]
- 手游传奇世界召唤骷髅书哪里打,传奇世界的强化骷髅书在哪弄呢要打什么怪呢
- 热血江湖刀外挂设置
- 【黑森林特产鱼种获取攻略】
- 杨过的神雕究竟是什么品种? 或许还是进口品种
- 烟雨江湖木匠在哪学